作者:Michaela Buffler
Buchi实验室
历史上很少有像牛奶这样的食品与人类密切相关的。公元5千年前就有家养的奶牛了,而印度奶牛至今被奉为神明。牛奶的味道不仅好,而且它也是健康和营养的食品。实际上,作为最有价值的食品之一,牛奶含有构筑肌肉的健康蛋白质、强壮骨骼和牙齿的钙、促进消化的乳糖以及强大免疫系统的维他命。牛奶蛋白质由于其含有大量的人体必须氨基酸而具有很大的价值,因此它是人体细胞(如肌肉、器官、皮肤、激素、酶)不可缺少的。
全世界农业牛奶每年的产量是609百万吨。最大的牛奶生产地是印度、美国和俄罗斯。欧盟(EU-15)每年生产120百万吨;因此这也是奶制品的最大的市场。[1][2]
全世界牛奶的消耗正日新月异的增长着(虽然主要是在奶制品消耗上)。食品企业用大量的方法处理牛奶,将之转化为不同的产品,从奶酪、糕点以及冰淇淋生产到肉类生产或者膳食处理生产中。[3]
由于牛奶运输和奶牛育种值的测定对蛋白质含量有很大的影响,因此需要对其进行定期测定。
多年以来,测定蛋白质的参考方法一直是凯氏定氮法[4]。这个方法是测定样品中氮的含量,然后乘以特殊因子(牛奶是6.38)来计算出蛋白质的含量。
图1 Kjedahl K-360

然而,牛奶中也含有其它来源的氮(非蛋白氮化合物=NPN),也包括了所有这些氮,并在蛋白质含量中显示出来。为了去除错误,在一些国家已经从计算总蛋白质含量到计算纯蛋白质含量。
介绍:
牛奶中蛋白质含量
牛奶中总蛋白质由大约94%的纯蛋白质(约3.1g/100g)和约6%非蛋白质(约0.2g/100g)组成。总蛋白质平均含量为3.3%。
总蛋白质
总蛋白质由蛋白质和其它包括在计算中的非蛋白氮化合物(NPN)组成,
纯蛋白
纯蛋白由酪蛋白和乳蛋白组成。
(纯蛋白=总蛋白-NPN)
NPN(非蛋白氮化合物)
NPN主要由尿素和其它氮化合物(如氨基氮、多肽氮、肌氨酸、角蛋白以及铵盐等)[5]。
方法
每个实验室适用不同的标准用于他们的方法测定(使用传统的官方建立方法如§35 LMBG, § 64LFGB, AOAC,ISO, EPA和DIN,或者其它官方没有要求的但是可节约化学试剂、快速处理时间和保护环境的方法),这就是为什么采用从原有方法衍生出来修改过的方法的原因。
图2 H2O2 抽吸模块

用H2O2 消解的凯氏过程· 用H2O2 消解法特别适用于高泡沫样品。然而为了能够执行此方法,需要一个特殊的抽吸模块(图2)来滴加H2O2。该抽吸模块的漏斗是装有玻璃沙芯,便于H2O2 的匀速流动。
H2O2 消化的好处:
·节约50%的消化时间
·消化过程无泡沫
·无重金属污染,保护环境
·用69%的硫酸替代98%的浓硫酸过程:在样品管中加入5g 牛奶样品,然后加入10mL H2O2(30%)和30mL 的硫酸(69%)。把H2O2 抽吸模块放置到
架子上。10min 消化后,再加入20mLH2O2。
微量凯式法
微量方法与官方方法处理方式一样。然而,与官方方法相比,这种方法需要更小体积的样品(1.8mL),更少的化学试剂量,消化时间也会显著减少。
凯氏方法过程(官方方法)
过程:
根据凯氏方法测定蛋白质时,牛奶样品用浓硫酸处理,生成硫酸铵盐。硫酸铵盐通过与碱NaOH反应,生成氨气,通过水蒸汽蒸馏被导入到硼酸吸收液中。然后用HCl或H2SO4滴定溶液滴定。
NPN测定
NPN测定的第一步就是用三氯乙酸将蛋白质沉淀。然后根据凯氏定氮法分析滤液。
牛奶直接蒸馏法
直接蒸馏法是一个简单快速的测定蛋白质的方法,其省略了消化这一步。
过程:
取10mL牛奶样品于样品管中。开始蒸馏之前,加入20mL氯化钡(10%)到样品中,然后采用与官方方法相同的过程。
牛奶样品在碱性溶液中加热,然后释放出氨气。由于蛋白质的组成部分谷氨酸和丙氨酸的快速水解生成大部分的氨气。该反应过程只需几分钟即可完成。另外,少量的氨气是由其它氨基酸完全分解而生成,但是这种分解速度很慢,不会影响该过程。该方法需要测定一个系数(转换系数)以简单地测定个氮和蛋白质含量。使用直接蒸馏方法,可以在10min内就可测定蛋白质含量。
表1 配置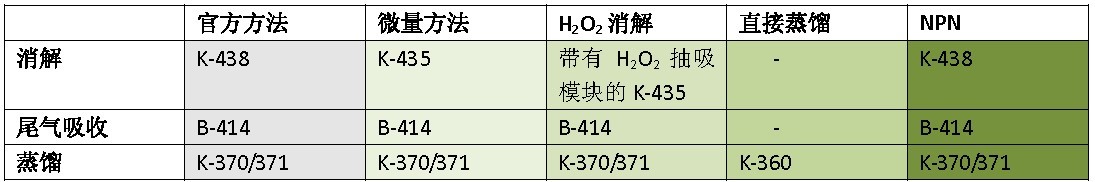
上述仪器用于该文章中描述的应用中,也可以使用其它来自Buchi 公司的蒸馏和消解仪。
表2 消化参数
表3 蒸馏参数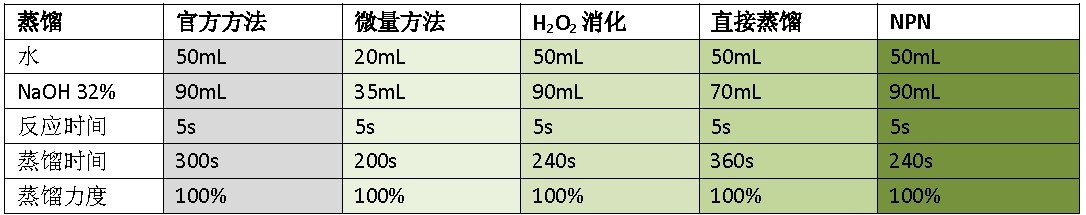
表4 滴定参数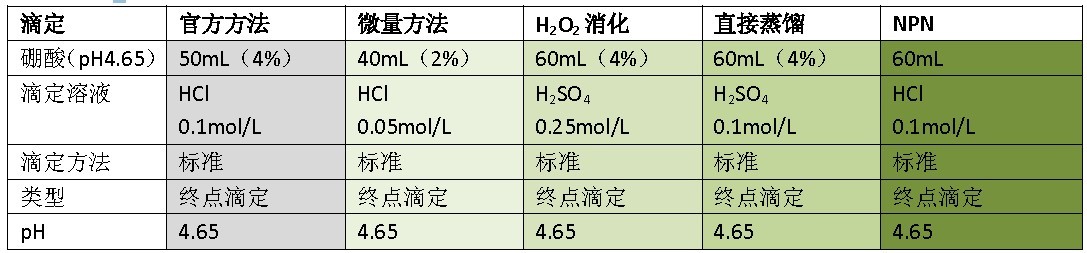
为了测定低浓度氮含量样品(<10mg N),为了能够更好的检测转折点,推荐使用低浓度的硼酸溶液(如2%,参见微量方法)。选择适当的样品质量/体积和滴定溶液的浓度,滴定溶液的消耗大约是5~20mL。
表5 结果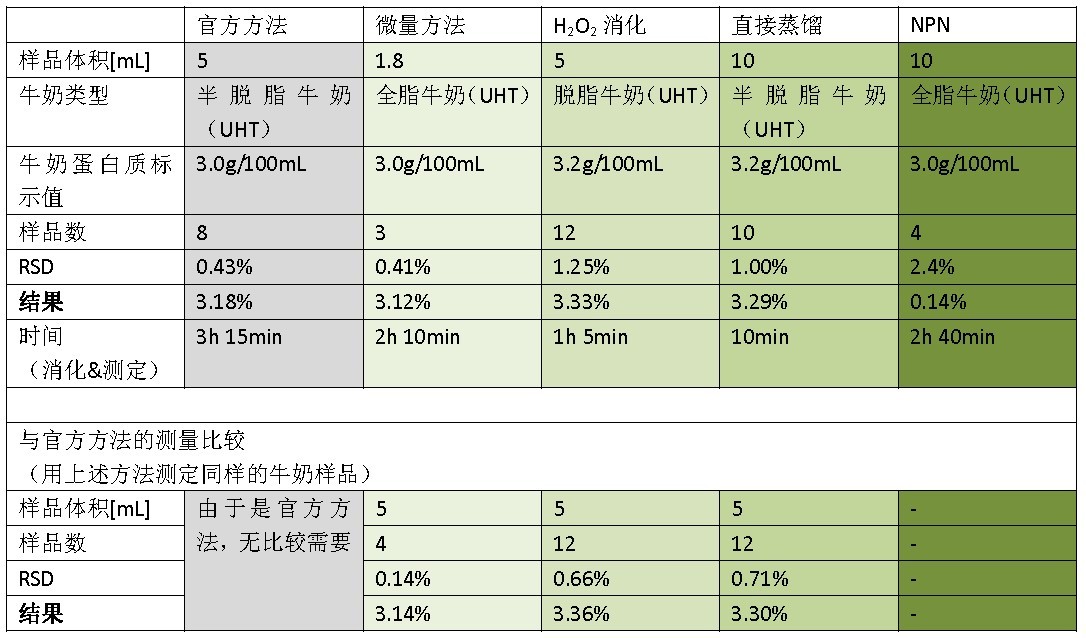
牛奶包装盒上的标示以g/mL为单位,这个标示值不能直接与获得的结果(g/g=%)做比较。因此虽然这个记过可以用于比较,但是不同的方法也可以与官方方法做比较。
结论
从上表可看出,优化的方法可获得重复性好的结果。这就意味着这些方法可作为大有益处的替代方法以进行实验室常规过程。
所有文章中提到的方法能够得到良好的结果。因此实验室可以选择适合自己要求的方法,如微量凯氏方法可以尽可能的减少化学物的使用,H2O2消化方法是为了获得快速而且准确的结果,或者直接蒸馏法是为了尽快的获得结果。然而,当需要强制使用官方方法(如AOAC,DIN),是不能够使用优化方法的。












