常见的染色方法包括简单染色、负染色、革兰氏染色、芽孢染色法、鞭毛染色、荚膜染色、死活染色。制备细菌染色片一般要经过涂片、固定、染色、水洗、干燥等步骤,然后用显微镜甚至油镜观察。
简单染色:
不同细菌或者由于观察者所侧重观察的内容不同,所以使用的染料也有差异,但是简单染色的方法是一样的。先按照上述的制片方法制片,制成需要观察的玻片后,使用相对应的染料滴加到玻片上的菌膜区域,以覆盖菌膜为准。按照不同染料的要求,结合所观察的内容确定染色时间,染色时间到达时,进行水洗,干燥等步骤。最后得到的玻片加盖盖玻片即可进行镜检。如有需要可以后续再进行油封、蜡封等封片过程。简单染色过程如下图:

负染色:
制备观察图片是非常容易的,但是对初学者来说想要在玻片中找到目标菌还是有一定难度的,因为细菌常常无色透明且比较小,所以对初学者来说除非对光圈等进行很精细的调节,否则很难观察到目标菌,因此进行负染色就十分重要。该方法是将微生物与苯胺黑或者india墨水混合,再将混合物覆盖于载玻片表面,由于这两种天然黑色染料不能渗入微生物细胞,所以使得透明的微生物个体在黑色的背景下很容易观察。负染色法常见有两种操作方法。
第一种发个方法比较常见,在一个载玻片上将微生物与异地苯胺黑混合,用另外的载玻片将混合物均匀的覆盖于原来的载玻片上。该方法的目的是使混合物在在玻片上一边厚一边薄,在厚与薄中间的额区域就是最佳观察区域。如图所示:
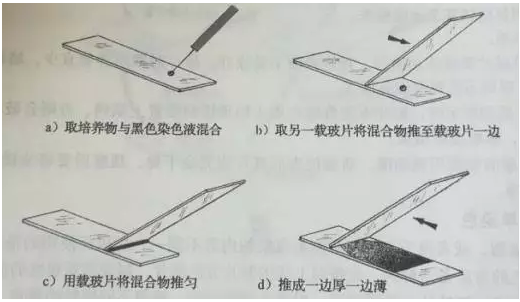
第二种方法是用一接种环苯胺黑与微生物混合,用接种针在载玻片的中央将混合物延伸很小的区域。具体操作如图所示:

革兰氏染色:
革兰氏染色是细菌学中广泛使用的一种鉴别染色法。细菌先经碱性染料结晶紫染色,而后经碘液进行媒染,之后用酒精脱色,在一定条件下有的细菌媒染后的颜色不会脱去,有的可以被脱去,前者叫做革兰氏阳性菌,后者为革兰氏阴性菌。为方便进一步观察,脱色后再用碱性蕃红进行复染,阳性菌仍为紫色,阴性菌染成红色,这就是革兰氏染色的原理。其步骤包括初染、媒染、脱色、复染四个步骤,主要步骤如图所示:

芽孢染色法:
部分细菌能产生内孢子,这些孢子能抵制细菌染色液的进入,在革兰氏染色法涂片染色时,革兰氏阳性菌的芽孢呈现无色。虽然芽孢在革兰氏染色片中可以看到,但在不易清晰观察时,可用特殊的芽孢染色法,使芽孢与菌体呈现不同颜色,便于观察。主要的芽孢染色法有孔雀绿染色法和石碳酸复红染色法。
孔雀绿染色法的具体步骤:首先将生有芽孢的斜面菌苔按革兰氏染色法涂片后,用饱和孔雀绿水溶液染色10min,然后用自来水冲洗,冲洗完后用0.5%蕃红液复染30s,用水洗,吸干,即可镜检,镜检时芽孢呈绿色,菌体和芽孢囊呈微红色。
石碳酸蕃红染色法具体步骤:首先按常规涂片,然后滴加石碳酸复红于涂片上,并于玻片下缓缓加热,使染液冒蒸汽但不沸腾,并继续滴加染液,不使涂片上染液蒸干,这样保持5min。带涂片冷却后,倾去染液,用酸性乙醇脱色指无红色染剂洗脱为止,接着彻底水洗,洗后用吕氏美蓝复染2-3min,水洗吸干后即可进行镜检,镜检时菌体计孢囊呈蓝色,芽孢呈红色。
鞭毛染色法:
鞭毛是细菌的运动器官,非常纤细,超出了光学显微镜观察极限,因此通常情况下在显微镜下观察不到。通过特殊的染色技术,可以将染色液附加到鞭毛的周围,增加它的直径,从而能在光学显微镜下观察到鞭毛。鞭毛染色一般分银盐法和复红沉淀法两种。这里介绍一下银盐沉淀法。用作鞭毛染色的载玻片必须是绝对干净无油脂的,将载玻片在火焰上快速灼烧5s,放在染色架上冷却,用蜡笔分成两个区域,然后用移液管或者巴斯德移液管吸取2mL无菌水加入到幼龄生长活跃的斜面菌株中,慢慢震荡并旋转试管使菌株悬浮,尽量避免使用接种环,将悬液转移到干净的试管中,通过悬滴试验检查菌体的运动型,用无菌水将悬浮液稀释至略有浑浊为止,放入20-30℃培养箱中培养30min,然后移取一满环悬浮液加在已冷却的载玻片一端,倾斜载玻片让液滴流到蜡笔画的中心线,在空气中自然干燥。然后用媒染色剂媒染5min之后,慢慢用蒸馏水充分漂洗掉所有的媒染液,用热的Fontana银盐覆盖,染色5min,每隔1min更换一次染色液(Fontana银液在沸水浴中加热),细菌涂层的每一部分都要浸在染色液中,不能裸露。最有用水冲洗,自然晾干即可进行镜检。应当注意一点,染色法的燃料须当日配制,4h内使用,最好是现配现用。
荚膜染色:
一般细菌的荚膜与染色剂的亲和性低,但荚膜通透性高,因此染料可以透过荚膜使菌体着色。一般采用负染色方法使背景和菌体之间形成一透明区,将菌体衬托出来便于观察分辨。荚膜染色的步骤:加一滴6%葡萄糖水溶液在载玻片的一端,无菌操作,挑取细菌斜面上培养72h左右的胶质芽孢杆菌与其混合,加1滴墨汁充分混匀,用推片法制片将菌液铺成薄层,自然干燥,滴加1-2滴无水乙醇覆盖涂片,固定1min,自然干燥,在已晾干的涂面上,滴加1%结晶紫染色液染色,2min后用20%的硫酸铜冲洗数次,再用自来水冲洗一次,使用擦镜纸擦干后即可镜检。有荚膜的菌菌体呈紫色,背景灰黑色,荚膜不着色呈无色透明圈。具体操作过程见下图:
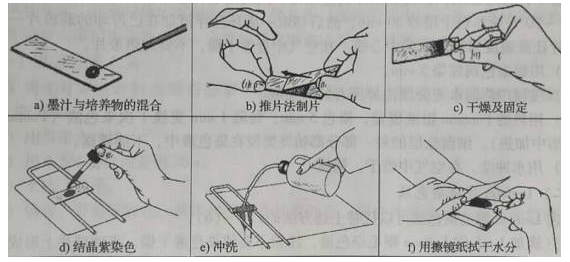
死活染色:
死活染色排除法是生物研究中判断细胞活性的一种常用方法,是利用死活细胞在生理机能和性质上的差异来进行的,常用的染色剂有台盼蓝和美蓝,前者使用范围较广,后者一般在酵母菌细胞死活鉴定上使用较多。
以上介绍的染色法,基本上涵盖传统微生物实验室能用到的所有的染色法。染色法在细菌的观察、分类、鉴定中经常用到,因此是微生物检测人员不可或缺的基本技能之一。












