引言:
阪崎肠杆菌(又称阪崎氏肠杆菌)是一种周身无鞭毛,能运动,无芽孢的兼性厌氧菌,革兰氏阴性杆菌。1980年由黄色阴沟肠杆菌更名为阪崎肠杆菌。阪崎肠杆菌能引起严重的新生儿脑膜炎、小肠结肠炎和菌血症,致死率可达40%~80%,自1961年首次由阪崎肠杆菌引起的新生儿脑膜炎之后,全球范围陆续出现感染事件,丹麦、希腊、英国、荷兰、冰岛等国均有报道。其严重性已引起世界多国相关部门的重视,阪崎肠杆菌已被世界卫生组织和许多国家确定为引起婴儿死亡的重要条件致病菌。我国也于2005年5月20日通过了《奶粉中阪崎肠杆菌检测方法》行业标准,并于同年10月实施,我国《婴儿配方食品》和《幼儿配方食品》相关标准规定婴幼儿配方奶粉、食品中禁止检出阪崎肠杆菌等致病菌。
一、阪崎杆菌的生物学特性
1 形态染色
阪崎肠杆菌属肠杆菌科肠杆菌属 , 因此本菌具备肠杆菌基本形态特征 : 革兰阴性粗短杆菌,有周身菌毛 , 无芽胞, 有动力[1] 。
2 培养特性
能在普通营养琼脂、血平板、麦康凯(MAC) 琼脂、伊红美兰 (EMB) 琼脂、脱氧胆酸琼脂等多种培养基上生长繁殖。培养最佳温度 25 ~ 36 ℃ , 在 6~ 45 ℃下都能生长 , 某些菌株可在 47 ℃下生长
[8] 。在胰蛋白胨琼脂 (TSA) 、脑心浸液琼脂(BH I) 及血平板上经 25 ~ 36 ℃培养 24 h 后 , 形成 1. 5 ~ 2. 5mm, 黄色菌落。在结晶紫中性红胆盐葡萄糖琼脂 (VRBG) 能产生紫红色菌落[2]。
二、阪崎杆菌的传统检测方法
阪崎肠杆菌检验程序见图 1。
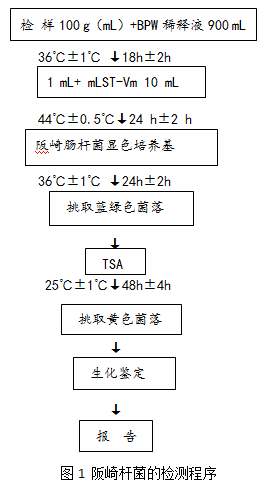
1 基本步骤如下:
取检样100g(mL)加入已预热至44℃装有900mL缓冲蛋白胨水的锥形瓶中,用手缓缓地摇动至充分溶解,36℃±1℃培养18 h±2h。移取1mL转种于10mL mLST-Vm肉汤,44℃±0.5 ℃培养24 h±2h。
轻轻混匀mLST-Vm 肉汤培养物,各取增菌培养物1环,分别划线接种于两个阪崎肠杆菌显色培养基平板,36℃±1℃培养18 h±2 h。
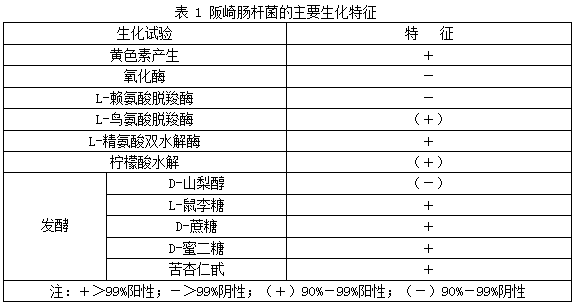
挑取1 个~5 个可疑菌落,划线接种于TSA平板。25℃±1℃培养48 h±4 h。 自TSA 平板上直接挑取黄色可疑菌落,进行生化鉴定。阪崎肠杆菌的主要生化特征见表 1。可选择生化鉴定试剂盒或全自动微生物生化鉴定系统。
2 结果与报告
综合菌落形态和生化特征,报告每100g(mL)样品中检出或未检出阪崎肠杆菌。
3 注意事项
(1)取样前应对样品包装的开启处和取样勺进行消毒
(2)检测样品不能低于333g
三、检测新技术简介
1 荧光法选择性培养基法
该方法也是利用α-葡萄糖苷酶活性的检测方法[3]。在营养琼脂基础上添加4 -甲基-伞形酮-α- D -葡萄糖苷 (α-MUG) 。阪崎肠杆菌在该培养基上形成黄色菌落 , 在紫外光照射下发生荧光。该法灵敏度和特异性都比较好 , 已在多个国家开展使用 , 均取得稳定可靠的结果。
2 对硝基酚光电比色法
利用阪崎肠杆菌的α-葡萄糖苷酶活性 , 分解对硝基酚-α- D -葡萄糖苷底物 , 释放黄色的对硝基酚 , 在 405 nm 波长下测定吸光度 , 根据吸光度的大小 , 确定样品中阪崎肠杆菌是否存在。方法是常规增菌 , 在 VRBG 或 TSA 平板上挑取可疑菌落 , 制备成一定浓度的菌悬液与底物混匀 , 37 ℃ 4 h 后进行比色测定[4]。
3 荧光定量 PCR 方法
荧光定量 PCR 技术的基本原理是在PCR 反应体系中加入荧光基团 , 该基团是一对合适的荧光物质 , 可以构成一个能量供体和能量受体对 , 其中供体的发射光谱和受体的吸收光谱重叠 , 在 PCR 反应基因扩增时 , 激发供体而释放的荧光能量正好被受体吸收 , 使得供体的荧光强度减弱而受体荧光强度增强 , 利用荧光信号强弱变化积累实时监测整个 PCR 反应过程 , 最后通过标准曲线对未知模板进行定量分析。
实时荧光定量 PCR 技术已广泛应用于多种食品微生物污染的检测。 SEO 等利用阪崎肠杆菌部分大分子合成(MMS) 操纵子基因序列建立了奶粉中阪崎肠杆菌的实时荧光定量 PCR 方法 , 能检测到
0.6-1g 奶粉中的阪崎肠杆菌 , 且比传统培养法检测时间从 6 ~ 7 天缩短至 2 天内完成。对 68株阪崎肠杆菌和 55 株非阪崎菌进行检测 , 未出现假阳性和假阴性 , 具有很好的特异性。
结语:
传统的检测方法存在操作繁琐,时间长等缺点,很难满足现代临床快速诊断和治疗的需求。要了解更准确,快速,简便,可靠的方法和技术,科学为此已作了大量的研究,试验方法和识别技术正在不断发展和完善,并在实践中不断取得新的进展。














