同时分离九种脂溶性维生素及胡萝卜素,可避免使用多种HPLC方法,并且可减少在对膳食补充剂和营养强化食品中的脂溶性维生素进行定性与定量分析时所需要进行的实验步骤。快速分离疏水性维生素及胡萝卜素可显著提升样品通量以及减少实验花费,因而可满足日益增加的法规依从性需求,以监测大量的分析工作。
沃特世提供的解决方案
配备光电二极管阵列(PDA)检测器的ACQUITY UPC2™系统
Empower® 3软件
ACQUITY UPLC® HSS C18色谱柱
关键词
维生素、胡萝卜素、脂溶性、维生素A乙酸盐、维生素A棕榈酸盐、维生素D2、α-生育酚、维生素E乙酸盐、维生素K1、维生素K2、番茄红素、β-胡萝卜素、合相色谱分离术、UPC2
引言
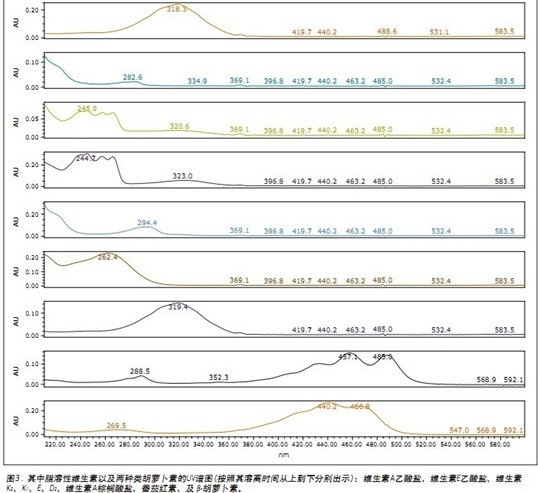
脂溶性维生素(FSV)包括维生素A、D、E、K及类胡萝卜素(例如β-胡萝卜素)。脂溶性维生素参与许多与重要生理功能相关的复杂代谢反应,例如视力(维生素A)、钙吸收(维生素D)、细胞膜的抗氧化(维生素E)、及血液凝固(维生素K)。1β-胡萝卜素是维生素A的前体,且在人体内具有100%维生素A活性。番茄红素不是人体的必需营养素,但它的抗氧化性能使它广受欢迎,越来越多地与其他成分一起被添加到某些膳食补充剂中。几种脂溶性维生素的化学结构如图1所示。

维生素及营养补充剂是一个价值几十亿的市场。预计在未来的五到十年,这一市场仍将继续增长。2这是由于全世界的消费者越来越追求更好以及更健康的生活方式,以及越来越注重健康以及饮食习惯。然而,人们也越来越关注从营养补充剂以及营养强化食品中所摄取的脂溶性维生素的安全性问题,特别是维生素A及D,若过量食用,也会带来严重的健康风险。3由于在许多国家,许多针对营养强化食品及膳食补充剂中所添加微量元素的合规性的法律正在拟定或制定中,因此,市场上必然对能够快速、准确地分析不同产品中的脂溶性维生素含量的分析方法有更高的需求。
目前,在进行FSV分离时,最常使用的是液相色谱(LC)方法,反向(RP)与正向(NP)方法均有。1,3-5虽然有AOAC法可用于对食品及营养补充剂当中的各种脂溶性维生素分别进行定性与定量分析,但却缺少一种可对维生素预混物中的脂溶性维生素以及类胡萝卜素同时进行分析的方法。
3由于超高效合相色谱(UPC2™))分离速度快、经济耐用,因此可考虑将其用于对含有多种脂溶性维生素的药物制剂进行快速分析。6在本应用纪要中,我们阐述了一种单次进样方法,它可在四分钟时间内同时分离九种脂溶性维生素。优化后的方法在保留时间以及峰面积方面具有良好的重现性,且可用于进行高通量定量分析。
实验
样品描述
七种脂溶性维生素:视黄醇乙酸盐(维生素A乙酸盐)、视黄醇棕榈酸盐(维生素A棕榈酸盐)、α-生育酚(维生素E)、α-生育酚乙酸盐(维生素E乙酸盐)、麦角骨化醇(维生素D2)、维生素K1、维生素K2 (MK-4);及两种胡萝卜素:番茄红素及β-胡萝卜素均购自西格玛公司(Sigma Aldrich),并且未经处理直接使用。将所有样品以约0.1 mg/mL的溶解到甲基第三丁基醚(MTBE)中,并转移到进样瓶中,准备进行分析。
UPC2条件
系统: 配备PDA检测器的ACQUITY UPC2
流速: 1 mL/min
流动相A:CO2
流动相B:乙腈
色谱柱: ACQUITY UPLC HSS C18 3.0 x 100 mm,1.8 µm
背压: 2500 psi
柱度: 30 °C
样品稀释剂:MTBE
进样量: 1µL
样品瓶: 沃特世玻璃瓶12 x 32 mm螺纹颈瓶,2 mL
PDA扫描范围:210 - 600 nm
数据管理: Empower 3软件
梯度:

结果与讨论
已有大量文献阐述了利用NPLC及RPLC分离脂溶性维生素以及类胡萝卜素的方法。1,3-5由于在分析脂溶性维生素时,通常需要使用低极性有机溶剂来溶解样本,因此NPLC由于其与有机溶剂的相容性而具有一定优势,可允许直接进样脂溶性维生素或脂溶性维生素萃取物,而不需要进行蒸发步骤。RPLC法的色谱分离效率虽然高于NPLC,7但由于以下几点原因,阻碍了其在进行FSV分析上的应用:1)分析物在流动相中溶解度较低,2)对FSV的保留力强,导致运行时间过长。最终,人们选择使用半水性流动相(甲醇或乙腈与水的混合物)或非水性流动相;后者也称为非水性反相(NARP) LC。7-8 UPC2,虽然常作为正相分离技术,但也同样适用于分离极性较低的分析物。UPC2的主流动相CO2不仅是低极性分析物的良好溶剂(与己烷的极性相近),也可与在样品分离过程中用于溶解这些分析物的有机溶剂(例如本研究中所使用的MTBE)相同。此外,CO2的低极性也可促进分析物与流动相之间的非极性相互作用,从而缩短保留时间和运行时间。
在进行方法开发时,共选用了六种色谱柱:ACQUITY UPLC HSS T3、ACQUITY UPLC HSS C18、ACQUITY UPC2 HSS SB、ACQUITY UPC2 CSH氟苯基、ACQUITY UPC2 2-乙基吡啶、及ACQUITY UPC2 BEH,
以及四种溶剂,包括:异丙醇(IPA)、乙腈(ACN)、乙醇、及IPA/ACN的1:1混合液。只有使用ACQUITY UPLC HSS C18色谱柱以及ACN的方法才可将非常相似的维生素K1以及K2分离。采用较低的柱温,30 °C,原因如下:首先,为了提高K1与K2的选择性;其次,为了最大限度地减少胡萝卜素在色谱柱上的降解,因为胡萝卜素非常容易氧化。
经方法优化后所得的每种成分的色谱图以及UV谱分别如图2及3所示。大体上,九种脂溶性维生素的洗脱顺序与它们的LogP值排序相同。利用低乙腈含量(2%)的流动相就可将七种维生素全部洗脱出来,而两种胡萝卜素则需要使用含20%乙腈的流动相才可洗脱出来。这一现象,可由分析物的结构以及它们与流动相/固定相之间的相互作用来解释。在九种分析物中,均存在CO2与脂溶性维生素亲脂性基团之间的非极性相互作用,而七种维生素中的氧原子(呈羰基或羧基的形式)使得分析物与流动相中的乙腈之间产生极性相互作用,这样就减少了溶离时间。而两种胡萝卜素分子不含有杂原子,且分子中的非极性十八烷基碳链更容易与固定相形成较强的相互作用,因而其溶离时间更长。

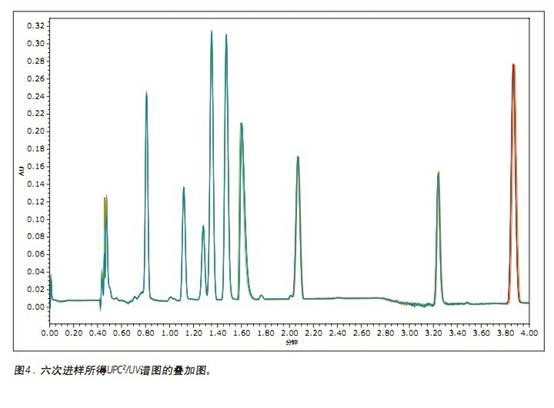
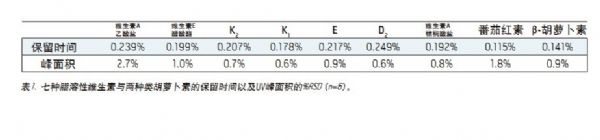
为了测试本方法的重现性,将九种脂溶性维生素分别进行六次进样,如图4所示。重现性统计数据已概括在表1中。保留时间的相对标准差(RSDs)小于0.25%。在峰面积方面,九种脂溶性维生素中,有七种的RSDs小于1%。第一个峰(维生素A乙酸盐)的RSD稍大,这是因为随着进样次数的增加,基线有所上升。不管怎样,重现性都应满足质量监测的要求,其通常要求某一测试方法的重现性公差为±20%。3
结论
在本应用纪要中,我们阐述了利用单次进样UPC2法,在四分钟内,将九种脂溶性维生素同时分离的方法。经过六次重复进样得知,九种物质的保留时间的RSD均小于0.25%,峰面积的RSD均小于3%(在大多数情况下<1%)。使用UPC2方法,只需进行一次进样就可将混合物中的各种脂溶性维生素分析完毕,而不需要像LC法那样进行多次操作,从而极大地减少了实验室的工作量。UPC2方法所需时间是传统分析方法的四分之一至十分之一。由于UPC2分析法分析速度较快,因此适于食品企业/营养补充剂企业等分析量通常较大的法规依从性监测。
参考文献
1. Santos J, Mendiola JA, Oliveira MBPP, Ibanez E, Herrero M. Sequential determination of fat- and water-soluble vitamins in green leafy vegetables during storage. J. Chromatogr. A. 2012; 1261:179-188.
2. http://www.prweb.com/releases/2011/10/prweb8906640.htm
3. Blake CJ. Status of Methodology for the Determination of Fat-Soluble Vitamins in Foods, Dietary Supplements, and Vitamin Premixes, J. AOAC Inter. 2007; 90(4):897-910.
4. Gomis DB, Fernandez MP, Gutierrez Alvarez MD. Simultaneous determination of fat-soluble vitamins and provitamins in milk by microcolumn liquid chromatography, J. Chromatogr. A. 2000; 891:109-114.
5. Salo-Vaananen P, Ollilainen V, Mattila P, Lehikoinen K, Salmela-Molsa E, Piironen V. Simultaneous HPLC analysis of fat-soluble vitamins in selected animal products after small-scale extraction, Food Chem. 2000;71:535-543.
6. Aubin A. Analysis of fat-soluble vitamin capsules using UltraPerformance Convergence Chromatography. Waters Application Note 720004394en. 2012 June.
7. Nelis HJCF, De Roose J, Vandenbaviere J, De Leenheer AP. Non-aqueous reversed-phase liquid chromatography and fluorimetry compared for determination of retinol in serum. Clin. Chem. 1983; 29(7):1431-1434.
8. Parris NA. Non-aqueous reversed phase liquid chromatography: a neglected approach to the analysis of low-polarity samples. J Chromatogr. 1978; 157:161-170.














